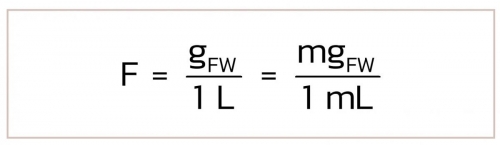การเตรียมสารละลาย
ขั้นตอนการเตรียมสารละลายในการวิเคราะห์สารที่สนใจใด ๆ นับว่าเป็นส่วนที่สำคัญสำหรับการทดลองเนื่องจากปริมาณ หรือความเข้มข้นของสารละลายที่ใช้ทำปฏิกิริยาใด ๆ ต้องสามารถนำมาคำนวณกลับหาความเข้มข้นของสารที่สนใจได้ตามปริมาณสัมพันธ์ ดังนั้น การเตรียมสารละลายจึงไม่ได้มีความหมายเพียงการนำสารเคมีมาละลายในตัวทำละลายเท่านั้น แต่ยังต้องคำนึงถึงความบริสุทธิ์ (assay) ปริมาณสารเจือปน (impurity) หรือปัจจัยอื่น ๆ การเตรียมสารละลายจากสารตั้งต้นที่เป็นของแข็งหรือของเหลว จำเป็นจะต้องทราบข้อมูลของสารเคมีนั้นเสียก่อน โดยดูได้จากฉลากที่ขวดสารเคมี ข้อมูลที่จำเป็น เช่น ชื่อสารเคมี สูตรโมเลกุล น้ำหนักโมเลกุล ข้อมูลแสดงความบริสุทธิ์ของสารเคมี ระดับความชื้น และองค์ประกอบของสารเคมี เป็นต้น ในการวิเคราะห์ที่ต้องการความแม่นสูง โดยเฉพาะการวิเคราะห์สารปริมาณน้อยมาก (trace analysis) อาจต้องนำสารเคมีมาทำให้บริสุทธิ์ก่อนนำไปเตรียมเป็นสารละลาย
โดยส่วนใหญ่สารเคมีที่จะนำมาเตรียมเป็นสารละลายจะเป็นของแข็งและของเหลว ขั้นตอนการคำนวณและวิธีการเตรียมสารละลายอาจสรุปได้ดังนี้
1) การคำนวณน้ำหนัก หรือปริมาตรที่ต้องการ เพื่อใช้สำหรับการเตรียมสารละลายในหน่วยความเข้มข้นที่ต้องการ ขั้นตอนนี้ต้องทราบว่าจะเตรียมสารละลายในหน่วยความเข้มข้นใด ปริมาตรที่ต้องการเตรียม และความสามารถในการละลาย เป็นต้น สารเคมีบางประเภทจำเป็นต้องผ่านการอบเป็นระยะเวลาอย่างน้อย 2 ชั่วโมงเสียก่อน เช่น สารมาตรฐานปฐมภูมิ (primary standard reagents) สำหรับการหาความเข้มข้นแน่นอน (standardization)
2) การชั่งหรือตวง ขั้นตอนนี้ผู้เตรียมต้องทำการชั่งหรือตวงสารตามที่คำนวณข้างต้น การเตรียมสารละลายที่ต้องการความเข้มข้นแน่นอนหรือถูกต้องนิยมใช้เครื่องชั่งไฟฟ้าละเอียด 4 ตำแหน่ง แต่ถ้าต้องการเตรียมสารละลายที่มีความเข้มข้นโดยประมาณจะใช้เครื่องชั่งไฟฟ้า 2 ตำแหน่ง และการตวงนิยมใช้ปิเปต (ผู้เตรียมควรศึกษาการใช้เครื่องชั่ง วิธีการชั่งอย่างถูกวิธีเพื่อให้ได้น้ำหนักสารที่ถูกต้อง) โดยเฉพาะการชั่งสารปริมาณน้อย ๆ ซึ่งอาจทำให้เกิดความคลาดเคลื่อนได้ ภาชนะสำหรับชั่งสารที่นิยมใช้ ได้แก่ ขวดชั่งสาร
3) การถ่ายสารที่ชั่งลงในขวดกำหนดปริมาตร (volumetric flask) ทำได้โดยการใช้ตัวทำละลายปริมาณเล็กน้อยละลายสารให้หมดเสียก่อน แล้วจึงเทใส่ขวดกำหนดปริมาตร หรืออาจเทของแข็งที่ชั่งลงในขวดกำหนดปริมาตรก่อนแล้วค่อยเติมตัวทำละลาย ควรใช้ตัวทำละลายล้างภาชนะที่ใช้ชั่งสารแล้วเทใส่ขวดกำหนดปริมาตร เนื่องจากอาจมีสารบางส่วนติดที่ผนังภาชนะ
4) การปรับปริมาตรด้วยตัวทำละลายให้ได้ปริมาตรตามที่ต้องการ ขวดกำหนดปริมาตรจะมีขีดบอกปริมาตร อย่าเติมให้สารละลายเกินขีดบอกปริมาตรเป็นอันขาด เนื่องจากจะไม่สามารถคำนวณความเข้มข้นแน่นอนได้ โดยให้ส่วนโค้งล่างของระดับปริมาตรตัวทำลายอยู่ระดับขีดบอกปริมาตรของขวดกำหนดปริมาตร โดยต้องดูที่ระดับสายตา
ขั้นตอนการเตรียมสารละลายโดยทั่วไปที่ต้องการความแม่นของความเข้มข้นจะต้องเตรียมโดยใช้อุปกรณ์ที่มีความแม่นที่ผ่านการทวนสอบ เช่น เครื่องชั่ง ปิเปต กระบอกตวง และขวดกำหนดปริมาตร เป็นต้น แต่ในกรณีที่ไม่ต้องการความแม่นของปริมาตรสารละลายมากนัก อาจใช้บีกเกอร์ในการเตรียมแบบประมาณ เนื่องจากสารละลายประเภทนั้นไม่อาจทราบความเข้มข้นแน่นอนได้อย่างแท้จริง แม้ใช้เครื่องแก้วที่มีปริมาตรแน่นอน เช่น สารละลายมาตรฐานทุติยภูมิ (secondary standard reagents)
ที่มาภาพ. เคมีวิเคราะห์: หลักการและเทคนิคการคำนวณเชิงปริมาณ (หน้า 43). โดย วรวิทย์ จันทร์สุวรรณ, 2563, สำนักพิมพ์จุฬาลงกรณ์มหาวิทยาลัย. [สั่งซื้อออนไลน์]
Link: ความเข้มข้นสารละลาย
การคำนวณการเตรียมสารละลายหน่วยโมลาร์
หน่วยโมลาร์เป็นหน่วยความเข้มข้นของสารละลายที่นิยมใช้กันมากในการทดลองและห้องปฏิบัติการเคมี การคำนวณและวิธีการเตรียมสารละลายหน่วยโมลาร์และขั้นตอนการเตรียมแบ่งเป็น 2 กรณี ดังนี้
1) กรณีสารตั้งต้นที่ใช้เตรียมเป็นของแข็ง คำนวณได้จากสมการ
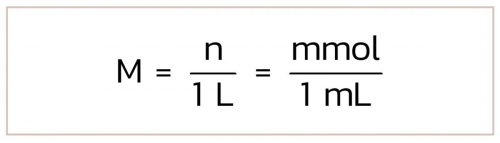
2) กรณีสารตั้งต้นที่เป็นสารละลาย
2.1) การคำนวณการเตรียมจากสารละลายเดียวกันที่มีความเข้มข้นสูงกว่า
M1V1 = M2V2
- M1 = ความเข้มข้นของสารละลายที่มีความเข้มข้นสูงกว่า (mol/L)
- M2 = ความเข้มข้นของสารละลายที่ต้องการเตรียม (mol/L)
- V1 = ปริมาตรของสารละลายที่มีความเข้มข้นสูงกว่า (mL)
- V2 = ปริมาตรสุทธิของสารละลายที่ต้องการเตรียม (mL)
การคำนวณกรณีนี้ ความเข้มข้นของสารละลายที่ต้องการเตรียมต้องเป็นหน่วยเดียวกับสารละลายที่มีความเข้มข้นสูงกว่า โดยปิเปตสารละลายที่มีความเข้มข้นสูงกว่าตามปริมาตรที่คำนวณได้ แล้วเจือจางด้วยน้ำจนมีปริมาตรตามที่ต้องการเตรียม
การคำนวณการเตรียมสารละลายหน่วยส่วนในล้านส่วน
การเตรียมสารละลายมาตรฐาน (standard solution) แบ่งเป็น 3 ประเภท ได้แก่
- สารละลายมาตรฐานที่ระบุความเข้มข้นของไอออน
- สารละลายมาตรฐานที่ระบุความเข้มข้นเฉพาะธาตุ
- สารละลายมาตรฐานที่ระบุความเข้มข้นของสารตามสูตรเคมี
การคำนวณและวิธีการเตรียมสารละลายจะต้องพิจารณาจากน้ำหนักไอออนหรือธาตุในสูตรเคมี เช่น ถ้าต้องการวิเคราะห์ไอออนฟลูออไรด์ในสารตัวอย่าง การเตรียมสารละลายมาตรฐานจะต้องคำนวณน้ำหนักฟลูออไรด์ในสูตรของสารประกอบฟลูออไรด์ที่นำมาเตรียม การเตรียมสารละลายมาตรฐานสำหรับวิเคราะห์ไอออนของสารที่ต้องการ จะต้องเลือกเกลือที่มีไอออนที่ต้องการทั้งในสถานะของแข็งและสารละลาย และสารนั้นจะต้องแตกตัวเป็นไอออนในน้ำได้ดีด้วย เช่น NaCl และ Na2SO4 โดยการเตรียมเป็นสารละลายมาตรฐานจะต้องคำนึงถึงสูตรเคมีของสารนั้นว่าหนึ่งหน่วยสูตรสามารถแตกตัวให้ไอออนจำนวนกี่ไอออน เช่น NaCl แตกตัวในน้ำให้ Na+ และ Cl- อย่างละ 1 ไอออน ส่วน Na2SO4 แตกตัวให้ Na+ 2 ไอออน และ SO42- 1 ไอออน


การคำนวณการเตรียมสารละลายหน่วยนอร์แมล
การคำนวณและวิธีการเตรียมสารละลายหน่วยนอร์แมล คำนวณดังนี้
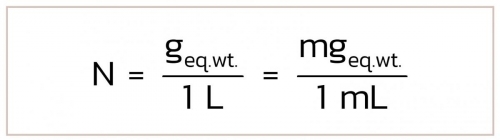
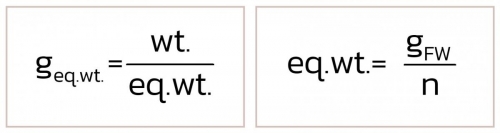
- wt. = น้ำหนักตัวละลาย (g)
- N = จำนวนนอร์แมล
- gFW = กรัมน้ำหนักสูตร (g/mol)
- V = ปริมาตรที่ต้องการเตรียม (mL)
- n = จำนวนเวเลนซี
น้ำหนักสมมูลของสาร ซึ่งจำนวนเวเลนซีจะต้องพิจารณาจากชนิดของสารนั้น ๆ ดังนี้
1) น้ำหนักสมมูลของกรด-เบส
- กรด จำนวนเวเลนซี คือ จำนวน H+ ที่สามารถถูกแทนที่ได้ด้วยโลหะ เช่น
- HCl มี n = 1
- H2SO4 มี n = 2
- เบส จำนวนเวเลนซี คือ จำนวน H+ ที่เข้าไปแทนที่ OH- ในเบส
- NaOH มี n = 1
- Ba(OH)2 มี n = 2
2) น้ำหนักสมมูลของเกลือ พิจารณาจากจำนวนเวเลนซีของแคตไอออนและแอนไอออน โดยจำนวนเวเลนซีของเกลือไอออน คือ ผลคูณระหว่างเลขจำนวนอะตอม (เลขตัวห้อย) ของแคตไอออนและแอนไอออน เช่น
- NaCl มี n = 1x1 = 1
- Al2(SO4)3 มี n = 2x3 = 6
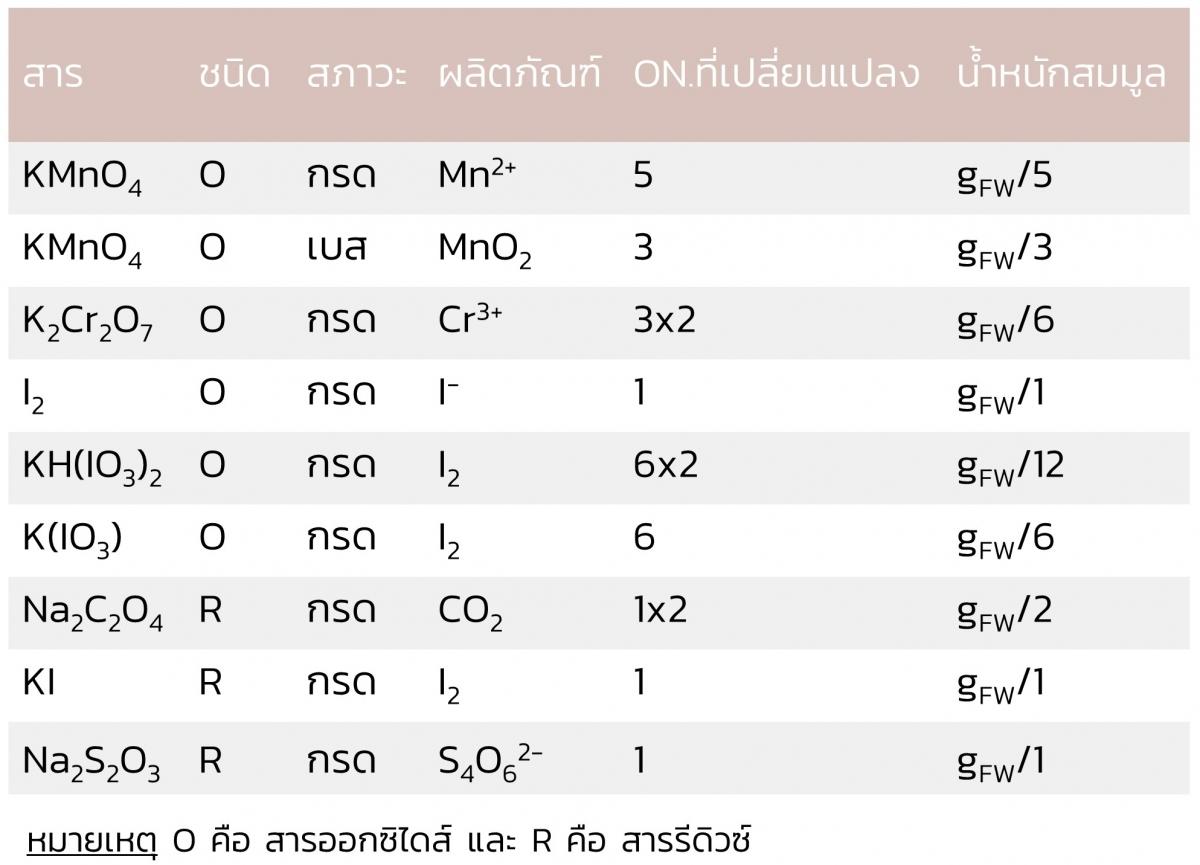
3) น้ำหนักสมมูลของสารออกซิไดส์ (oxidizing agent) หรือสารรีดิวซ์ (reducing agent) ในปฏิกิริยารีดอกซ์ พิจารณาจากเลขออกซิเดชัน (oxidation number) ที่เปลี่ยนแปลงไปต่อ 1 โมเลกุล
สารออกซิไดส์หรือสารรีดิวซ์ที่นิยมใช้ในการไทเทรตหรือการวิเคราะห์ทางเคมี แสดงดังตารางซึ่งจะเห็นว่าเลขออกซิเดชันที่เปลี่ยนแปลงไปในปฏิกิริยารีดอกซ์ขึ้นกับสภาวะกรด-เบสของสารละลายด้วย

การคำนวณการเตรียมสารละลายหน่วยร้อยละ
การคำนวณการเตรียมสารละลายหน่วยร้อยละต้องพิจารณาจากชนิดของหน่วยร้อยละ เช่น %/w/w %w/v และ %v/v


การคำนวณการเตรียมสารละลายหน่วยฟอร์แมล