ผู้ช่วยศาสตราจารย์ ดร.วรวิทย์ จันทร์สุวรรณ
ปรับปรุงล่าสุด: 4 มิถุนายน 2563

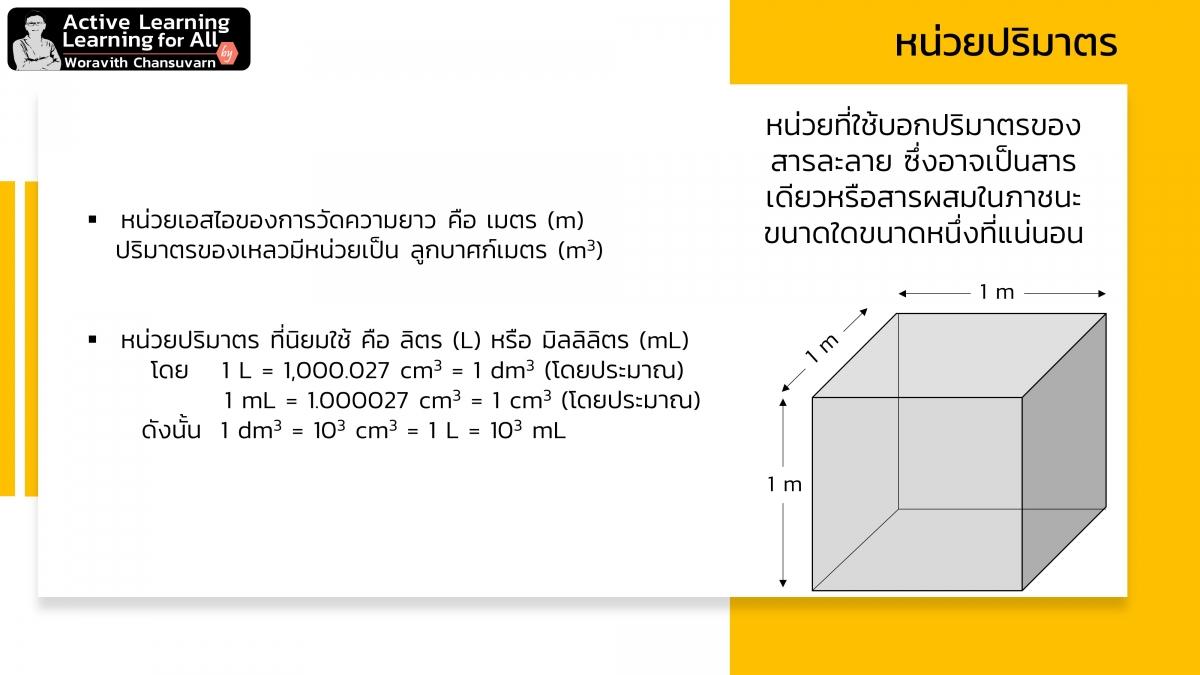
ความเข้มข้นสารละลาย (concentration) คือ การบอกปริมาณตัวละลาย (solute) ในตัวทำละลาย (solvent) ที่มีปริมาตรแน่นอนปริมาตรหนึ่ง
ความเข้มข้นสารละลาย นับได้ว่ามีความสำคัญมากต่อการเรียนและการปฏิบัติทดลองด้านเคมี เนื่องจาก ความเข้มข้นสารละลายเป็นเป็นความสัมพันธ์เชิงโมลของสารที่ใช้ในการทำปฏิกิริยาเคมี ดังนั้น เราจำเป็นต้องศึกษาและทำความเข้าใจความเข้มข้นสารละลายอย่างถูกต้อง
ความเข้มข้นสารละลาย ที่นิยมใช้ในการทดลองทางเคมี มีหลายหน่วย เช่น โมลาร์ นอร์มัล ร้อยละ เป็นต้น
หน่วยร้อยละ (%)
ความเข้มข้นสารละลายในหน่วยร้อยละแบ่งได้เป็น 3 ชนิด
1) ร้อยละโดยน้ำหนักต่อน้ำหนัก (%weight per weight; %w/w) หรืออาจเรียกว่า ร้อยละโดยน้ำหนัก หมายถึง น้ำหนักเป็นกรัมของตัวละลายในสารละลาย 100 g เช่น NaCl 35%w/w มีความหมายว่า สารละลาย 100 g จะประกอบด้วย NaCl 35 g และน้ำ 65 g
2) ร้อยละโดยน้ำหนักต่อปริมาตร (%weight per volume; %w/v) หมายถึง น้ำหนักของตัวละลายเป็นกรัมในสารละลายปริมาตร 100 mL เช่น NaCl 5%w/v มีความหมายว่า สารละลาย 100 mL มี NaCl ละลายอยู่ 5 g
3) ร้อยละโดยปริมาตรต่อปริมาตร (%volume per volume; %v/v) หรืออาจเรียกว่า ร้อยละโดยปริมาตร หมายถึง ปริมาตรของตัวละลายหน่วย mL ในสารละลายปริมาตร 100 mL มักใช้กับสารละลายที่เกิดจากการละลายของเหลวในของเหลว เช่น เอทานอล (C2H5OH) 10%v/v ในน้ำ มีความหมายว่า สารละลายเอทานอล 100 mL มีเอทานอลละลายอยู่ 10 mL
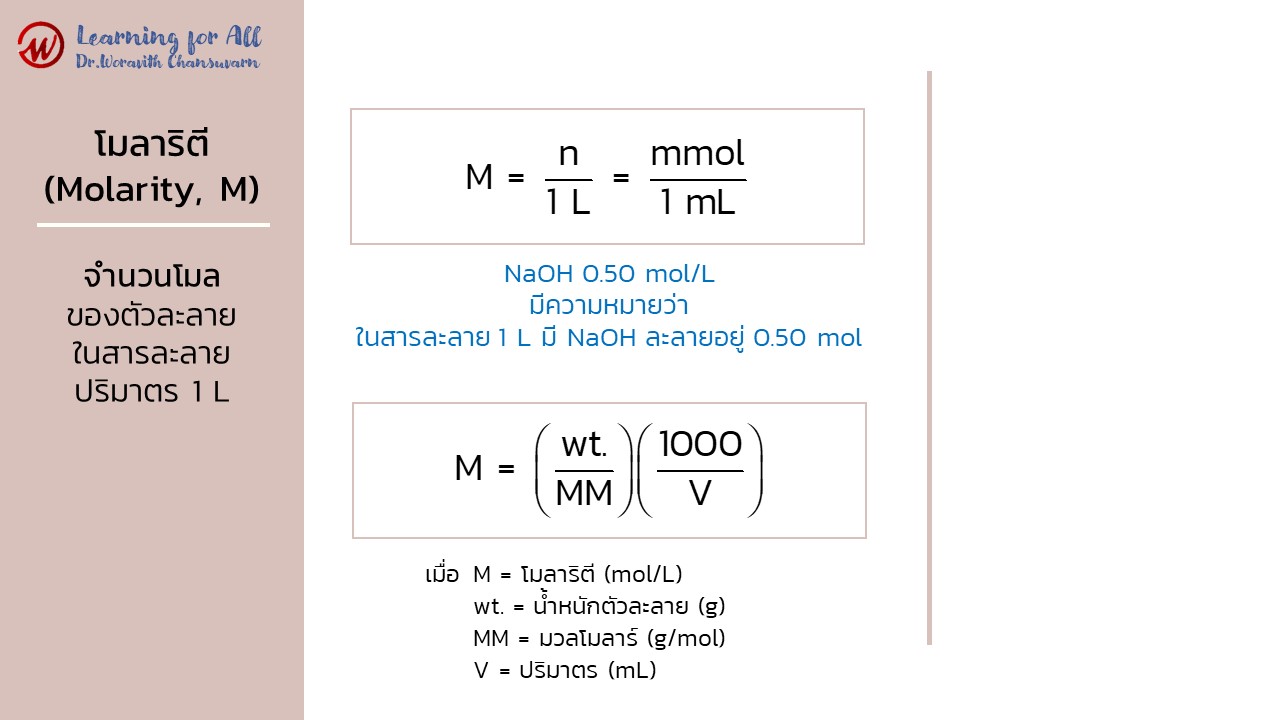
หน่วยโมลาริตี (molarity; M)
หน่วยโมลาริตี (molarity; M) หรือเรียกว่า โมลาร์ (molar) คือ ความเข้มข้นสารละลายบอกถึงจำนวนโมลของตัวละลายในสารละลายปริมาตร 1 L เช่น NaOH 0.50 mol/L มีความหมายว่า ในสารละลาย 1 L มี NaOH ละลายอยู่ 0.50 mol
เมื่อ n = จำนวนโมลตัวละลาย (mol)
mmol = จำนวนมิลลิโมลตัวละลาย (mmol)
หน่วยโมลาร์ มีหน่วยเป็น โมลต่อลิตร (mol/L) ในการเตรียมสารละลายที่มีปริมาตรตัวทำละลายใด ๆ สามารถคำนวณความเข้มข้นในหน่วยโมลาร์หรือน้ำหนักสารที่ต้องชั่งโดยใช้สูตร ดังนี้
เมื่อ wt. = น้ำหนักตัวละลาย (g)
V = ปริมาตรที่ต้องการเตรียม (mL)
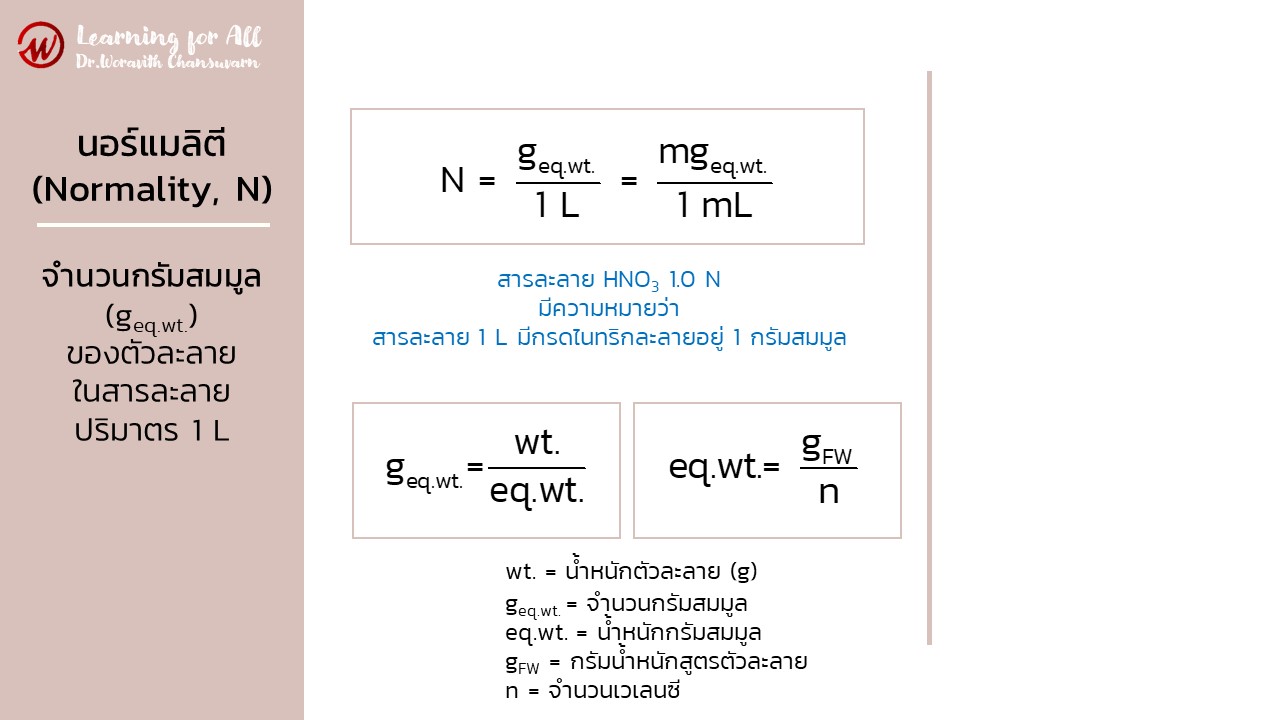
หน่วยนอร์แมลิตี (normality; N)
หน่วยนอร์แมลิตี (normality; N) หรือเรียกว่า นอร์แมล (normal) คือ ความเข้มข้นสารละลายบอกถึงจำนวนกรัมสมมูล (geq.wt.) ของตัวละลายในสารละลายปริมาตร 1 L เช่น สารละลายกรดไนทริก (HNO3) 1.0 N มีความหมายว่า ในสารละลายปริมาตร 1 L มีกรดไนทริกละลายอยู่ 1 กรัมสมมูล
geq.wt. = N x V
เมื่อ geq.wt. = จำนวนกรัมสมมูล (gram equivalent weight)
เมื่อ eq.wt. = น้ำหนักกรัมสมมูล
gFW = กรัมน้ำหนักสูตรตัวละลาย
n = จำนวนเวเลนซี
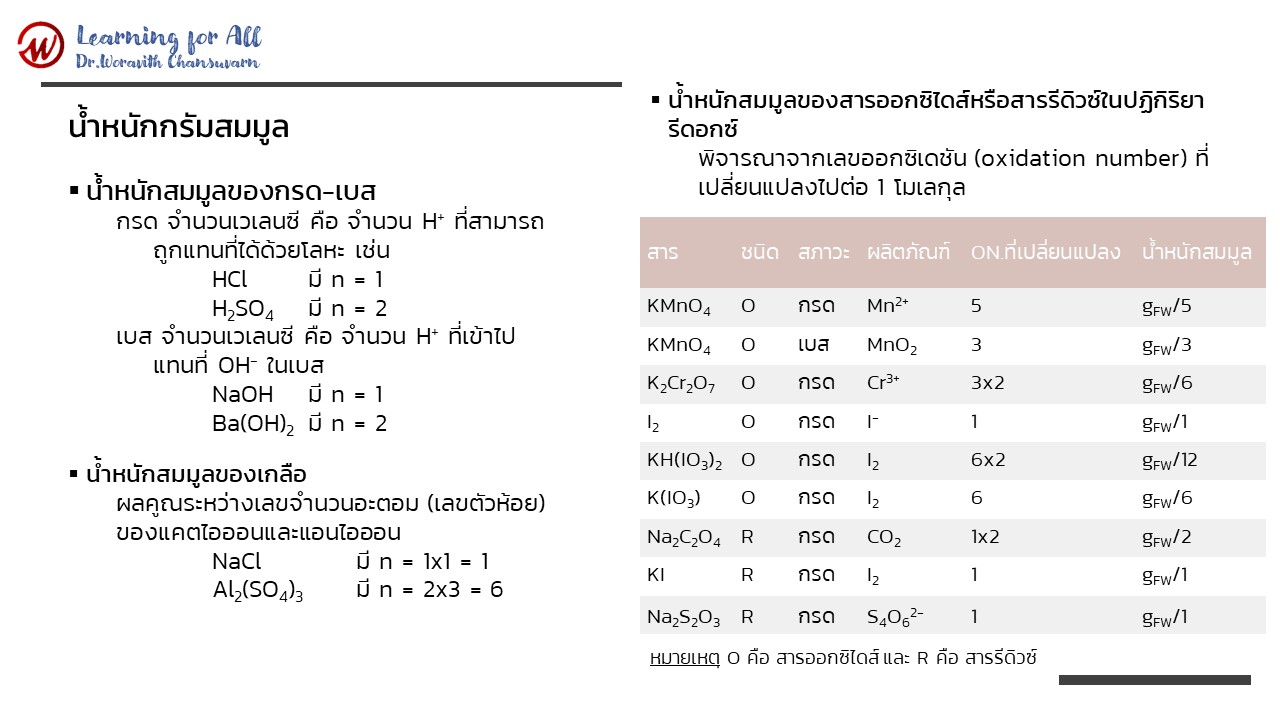
น้ำหนักสมมูลของสาร คำนวณได้จากสมการ (2.19) ซึ่งจำนวนเวเลนซีจะต้องพิจารณาจากชนิดของสารนั้น ๆ ดังนี้
1) น้ำหนักสมมูลของกรด-เบส
กรด จำนวนเวเลนซี คือ จำนวน H+ ที่สามารถถูกแทนที่ได้ด้วยโลหะ เช่น
HCl มี n = 1
H2SO4 มี n = 2
เบส จำนวนเวเลนซี คือ จำนวน H+ ที่เข้าไปแทนที่ OH- ในเบส
NaOH มี n = 1
Ba(OH)2 มี n = 2
2) น้ำหนักสมมูลของเกลือ พิจารณาจากจำนวนเวเลนซีของแคตไอออนและแอนไอออน โดยจำนวนเวเลนซีของเกลือไอออน คือ ผลคูณระหว่างเลขจำนวนอะตอม (เลขตัวห้อย) ของแคตไอออนและแอนไอออน เช่น
NaCl มี n = 1x1 = 1
Al2(SO4)3 มี n = 2x3 = 6
3) น้ำหนักสมมูลของสารออกซิไดส์ (oxidizing agent) หรือสารรีดิวซ์ (reducing agent) ในปฏิกิริยารีดอกซ์ พิจารณาจากเลขออกซิเดชัน (oxidation number) ที่เปลี่ยนแปลงไปต่อ 1 โมเลกุล
สารออกซิไดส์หรือสารรีดิวซ์ที่นิยมใช้ในการไทเทรตหรือการวิเคราะห์ทางเคมี แสดงดังตารางซึ่งจะเห็นว่าเลขออกซิเดชันที่เปลี่ยนแปลงไปในปฏิกิริยารีดอกซ์ขึ้นกับสภาวะกรด-เบสของสารละลายด้วย
ตารางที่ 1 น้ำหนักสมมูลของสารออกซิไดส์หรือสารรีดิวซ์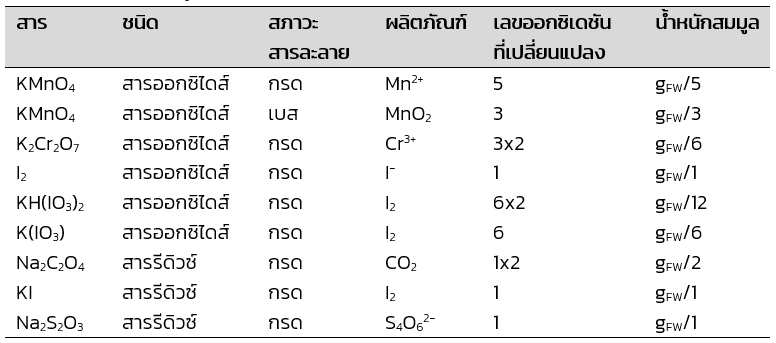
ที่มาจาก เคมีวิเคราะห์: หลักการและเทคนิคการคำนวณเชิงปริมาณ (หน้า 37) โดย วรวิทย์ จันทร์สุวรรณ, 2565, สำนักพิมพ์จุฬาลงกรณ์มหาวิทยาลัย.
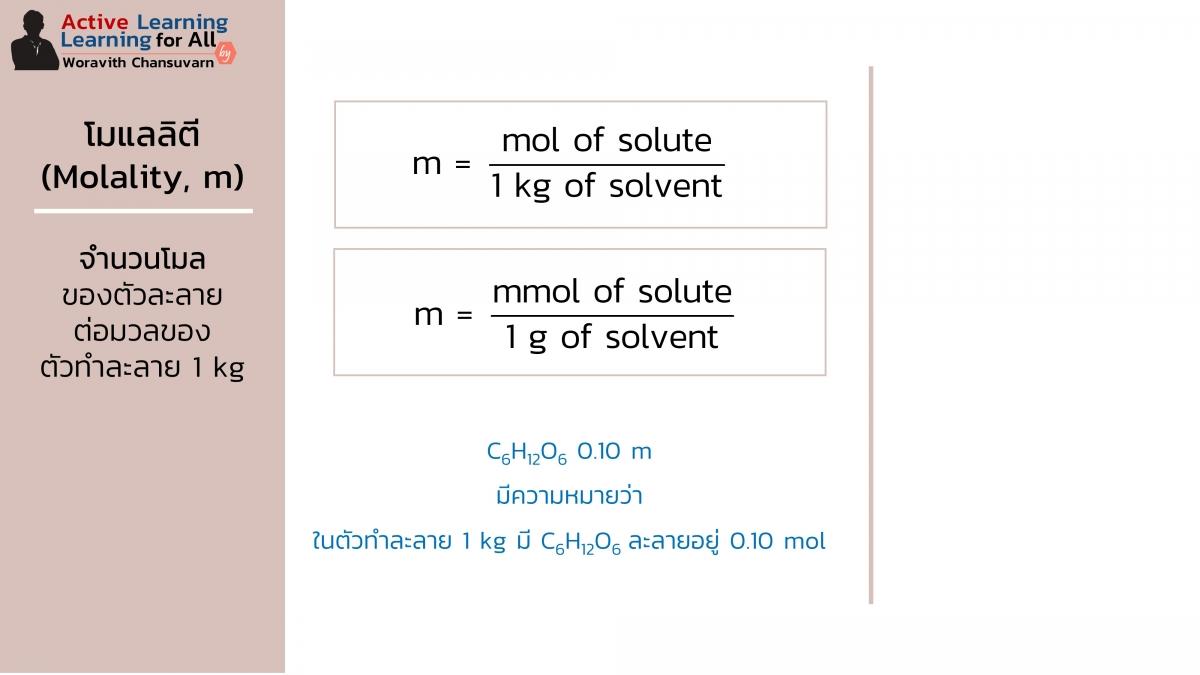
หน่วยโมแลลิตี (molality; m)
หน่วยโมแลลิตี (molality; m) หรือเรียกว่า โมแลล (molal) คือ ความเข้มข้นสารละลายบอกถึงหน่วยความเข้มข้นที่เป็นอัตราส่วนของจำนวนโมลของตัวละลายต่อมวลของตัวทำละลาย 1 กิโลกรัม
หน่วยส่วนในล้านส่วน (part per million; ppm)
หน่วยส่วนในล้านส่วน (part per million; ppm) คือ น้ำหนักตัวละลายในหนึ่งล้านส่วนน้ำหนักของสารละลาย โดยหน่วยนี้ใช้กับระบบสารละลายที่มีปริมาณตัวละลายน้อยมาก นิยมเรียกอย่างย่อว่า พีพีเอ็ม (ppm) รูปแบบหน่วยส่วนในล้านส่วนที่นิยมใช้ในรายงานวิจัย คือ mg/L, µg/mL, mg/kg และ µg/g เป็นต้น เช่น
- ZnSO4 10.0 ppm หมายความว่าในสารละลายล้านส่วนมี ZnSO4 ละลายอยู่ 10.0 ส่วน (หรือ 10.0 mg/L)
- Zn2+ 10.0 ppm หมายความว่าในสารละลายล้านส่วนมี Zn2+ ละลายอยู่ 10.0 ส่วน (หรือ 10.0 mg/L)
- KCl 100.0 ppm หมายความว่าในสารละลายล้านส่วนมีละลายอยู่ 100.0 ส่วน หรือ 100.0 mg/L)
- Cl- 100.0 ppm หมายความว่าในสารละลายล้านส่วนมี Cl- ละลายอยู่ 100.0 ส่วน (หรือ 100.0 mg/L)
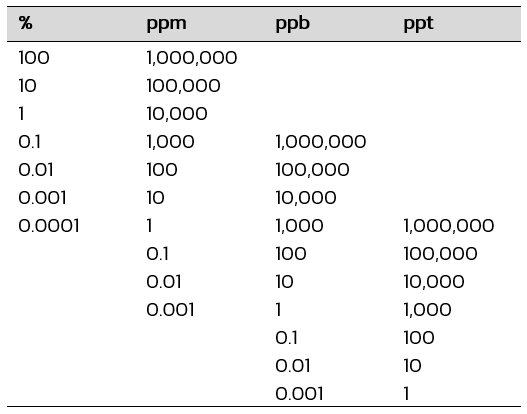
หน่วยความเข้มข้นที่มีปริมาณตัวละลายน้อยมาก
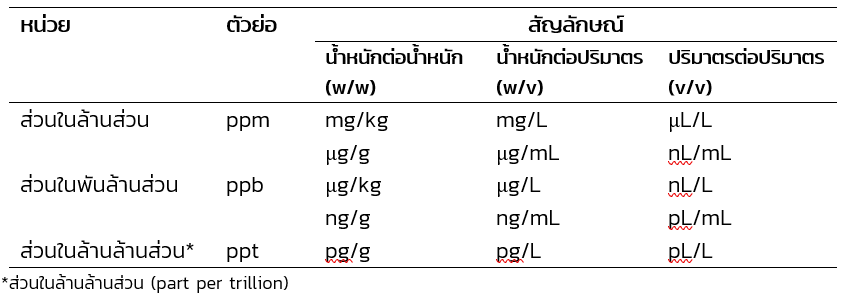
การเทียบหน่วยความเข้มข้นที่มีปริมาณตัวละลายน้อยมาก
อัตราส่วนเจือจาง (dilution ratio)
อัตราส่วนเจือจาง (dilution ratio) คือ อัตราส่วนโดยปริมาตรระหว่างสารสองชนิด หรือมากกว่าสองชนิด โดยระบุอัตราส่วนเป็นตัวเลขอยู่ในวงเล็บและคั่นด้วยเครื่องหมายทวิภาค (:) อัตราส่วนเจือจางนิยมใช้ในสารละลายกรดและเบสในน้ำ เลขตัวแรกแสดงถึงปริมาตรของกรดหรือเบส ส่วนตัวเลขหลังแสดงถึงปริมาตรของน้ำที่ใช้เจือจาง เช่น กรด HCl (1:2) หมายถึง ในสารละลายกรด HCl 3 ส่วน ประกอบด้วยกรด HCl เข้มข้น 1 ส่วน และมีน้ำ 2 ส่วน หรืออาจกล่าวได้ว่า กรด HCl เข้มข้น 1 หน่วยปริมาตร ต่อน้ำ 2 หน่วยปริมาตร
ตัวอย่าง จงอธิบายการเตรียมสารละลายกรดไนทริก (HNO3) ในน้ำให้มีความเข้มข้น (2:3) ปริมาตร 100 mL
วิธีคิด สารละลายกรด HNO3 เข้มข้น (2:3) ปริมาตร 100 mL หมายความว่า ในสารละลายกรด HNO3 100 mL มีกรด HNO3 2 หน่วยปริมาตร ต่อน้ำ 3 หน่วยปริมาตร
สารละลายกรด HNO3 5 ส่วน เท่ากับ 100 mL ดังนั้น 1 ส่วน เท่ากับ 20 mL
ดังนั้น ต้องใช้ HNO3 40 mL ผสมกับน้ำ 60 mL