วัตถุประสงค์
- เพื่อฝึกทักษะการทดลองเกี่ยวกับกฎของแก๊ส
- เพื่อฝึกทักษะการคำนวณหาค่าคงที่ของแก๊ส
Download
- บทปฏิบัติการ [pdf]
- รายงานการทดลอง [pdf]
แก๊ส เป็นสถานะหนึ่งของสสาร (อันได้แก่ ของแข็ง ของเหลว แก๊ส และพลาสมา) ซึ่งจะกลายเป็นของแข็งได้เมื่ออุณหภูมิลดลง การเปลี่ยนสถานะของสารจากของแข็ง เป็นของเหลวและแก๊ส ประเภทของแก๊สแบ่งได้เป็น 2 ประเภทดังนี้
1) แก๊สอุดมคติ (Ideal gas) หรือแก๊สสมบูรณ์ เป็นแก๊สที่ นักวิทยาศาสตร์กำหนดขึ้นเพื่ออธิบายสมบัติต่าง ๆ ที่เกี่ยวกับแก๊ส โดยให้มีพฤติกรรมเป็นไปตามทฤษฎีจลน์ของแก๊สไม่ว่าที่อุณหภูมิหรือความดันใด แก๊สสมบูรณ์เป็นแก๊สที่ไม่มีแรงยึดเหนี่ยวระหว่างโมเลกุล
2) แก๊สจริง (Real gas) เป็นแก๊สที่มีอยู่จริงในธรรมชาติ และไม่เป็นไปตามกฎต่าง ๆ ของแก๊สสมบูรณ์ มีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อย แต่ในบางสภาวะแก๊สจริงอาจมีสมบัติใกล้เคียงกับแก๊สสมบูรณ์ได้ คือที่อุณหภูมิสูงและความดันต่ำมาก ๆ แก๊สจริงที่มีสมบัติใกล้เคียงกับแก๊สสมบูรณ์ในสภาวะปกติมากที่สุดคือแก๊สเฉื่อยหรือแก๊สในหมู่ที่
สมการแก๊สสมบูรณ์แบบ
PV = nRT (7.1)
เมื่อ P = ความดัน (atm)
V = ปริมาตร (L)
n = จำนวนโมล (mol)
T = อุณหภูมิ (K)
R = ค่าคงที่ของแก๊ส (gas constant)
ในการทดลองเกี่ยวกับกฎของแก๊สอาศัยการทดลองการเตรียมแก๊สไฮโดรเจน จากปฏิกิริยาระหว่าง Mg กับ HCl ดังสมการ
Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g) (7.2)
ซึ่งแก๊สที่เกิดขึ้นเป็นแก๊สจริง (real gas) ทำการทดลองโดยเก็บแก๊สโดยการแทนที่น้ำ จากค่าปริมาตร อุณหภูมิ ความดัน และจำนวนโมลของแก๊ส จะสามารถหาค่า R ได้ ในการทดลองนี้เลือกใช้ปฏิกิริยาระหว่าง Mg กับ HCl (สมการ 7.2) จะเห็นได้ว่า Mg จำนวน 1 โมล ทำปฏิกิริยาพอดีกับ HCl จำนวน 2 โมล แล้วเกิด H2 1 โมลด้วย ปฏิกิริยาหนึ่งๆ สารกำหนดปริมาณ อาจจะเป็นสารตัวใดก็ได้ ที่เป็นตัวเข้าทำปฏิกิริยาและเป็นตัวจำกัดให้ปฏิกิริยาสิ้นสุดลง
ความดันของแก๊สไนโตรเจน ที่เก็บโดยการแทนที่น้ำ ได้จากการหักค่าความดันไอน้ำอิ่มตัว (vapor pressure of water) ดังตารางที่ 7.1 ออกจากค่าความดันบรรยากาศที่อุณหภูมิเดียวกันกับอุณหภูมิของแก๊ส
ตารางที่ 7.1 ค่าความดันไอน้ำอิ่มตัวที่อุณหภูมิต่าง ๆ
| อุณหภูมิ (°C) | ความดัน (Pa) | อุณหภูมิ (°C) | ความดัน (Pa) | อุณหภูมิ (°C) | ความดัน (Pa) |
| 0 | 610.472 | 17 | 1937.14 | 34 | 5319.20 |
| 1 | 656.734 | 18 | 2063.39 | 35 | 5622.77 |
| 2 | 705.795 | 19 | 2197.71 | 40 | 7375.80 |
| 3 | 757.924 | 20 | 2337.77 | 45 | 9583.04 |
| 4 | 813.385 | 21 | 2486.42 | 50 | 12333.4 |
| 5 | 872.313 | 22 | 2643.34 | 55 | 15737.1 |
| 6 | 934.973 | 23 | 2808.79 | 60 | 19915.3 |
| 7 | 1001.63 | 24 | 2983.30 | 65 | 25002.8 |
| 8 | 1072.56 | 25 | 3167.15 | 70 | 31156.9 |
| 9 | 1147.75 | 26 | 3360.86 | 75 | 38542.8 |
| 10 | 1227.74 | 27 | 3564.84 | 80 | 47341.9 |
| 11 | 1312.40 | 28 | 3779.49 | 85 | 57807.6 |
| 12 | 1402.26 | 29 | 4005.33 | 90 | 70094.3 |
| 13 | 1497.32 | 30 | 4242.78 | 95 | 84511.5 |
| 14 | 1589.11 | 31 | 4492.22 | 100 | 101323 |
| 15 | 1704.90 | 32 | 4754.59 | 105 | 120797 |
| 16 | 1817.67 | 33 | 5030.03 |
อุปกรณ์และสารเคมี
อุปกรณ์
- บิวเรต
- ขวดรูปชมพู่ 250 mL
- จุกยางพร้อมหลอดแก้วและสายยางนำแก๊ส
- กระบอกตวง
- บีกเกอร์
- ท่อแก้วรูปตัวยู
- เทอร์โมมิเตอร์
สารเคมี
- ลวดแมกนีเซียม (Mg) ขัดผิวด้วยกระดาษทราย ตัดเป็นชิ้นเล็ก ๆ
- สารละลาย HCl 1.0 mol/L
วิธีการทดลอง
การจัดเตรียมเครื่องมือการทดลอง
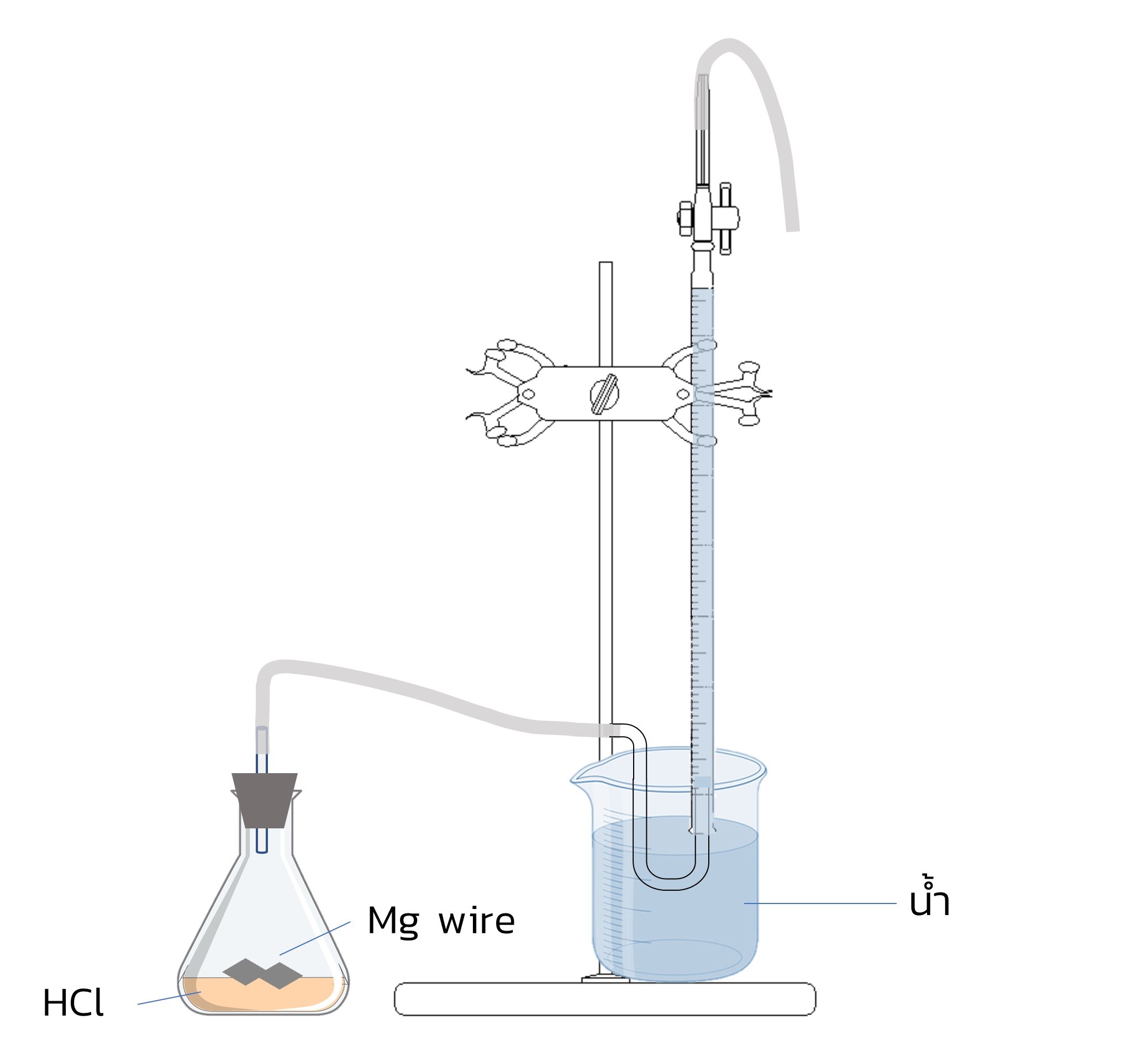
- เตรียมอุปกรณ์การทดลองดังภาพที่ 7.1 ควรจะล้างขวดรูปชมพู่ให้สะอาด คว่ำบิวเรตลงในบีกเกอร์ขนาด 250 mL ที่บรรจุน้ำประมาณ 200 mL โดยให้ปลายบิวเรตครอบท่อนำแก๊สที่ปลายอีกด้านมีจุดยางปิดปากขวดรูปชมพู่ได้สนิท
- ควรระมัดระวังในการอ่านปริมาตรน้ำเพราะเป็นการอ่านกลับข้างของตัวเลขที่ปรากฏอยู่ที่ด้านข้างของบิวเรต ถ้าระดับน้ำอยู่ที่ 50.00 mL ก็แสดงว่าปริมาตรของน้ำในบิวเรตเป็น 50.00 mL เมื่อมีการแทนที่น้ำด้วยแก๊สที่เกิดขึ้นจากการทดลอง ปริมาตรของแก๊สจะเท่ากับผลต่างของปริมาตรของน้ำในบิวเรตตอนเริ่มต้นและตอนที่ปฏิกิริยาสิ้นสุดแล้ว
ภาพที่ 7.1 การจัดอุปกรณ์ที่ใช้ในการหาปริมาตรของแก๊ส
การทดลองการเตรียมแก๊สไฮโดรเจน
- ชั่งลวดแมกนีเซียม หนักประมาณ 0.02xx-0.03xx g
- ตวงสารละลาย HCl 1.0 mol/L ปริมาตร 10.0 mL ด้วยกระบอกตวงใส่ในขวดรูปชมพู่ขนาด 250 mL แล้ววัดอุณหภูมิสารละลายในขวดรูปชมพู่ก่อน
- ใส่ลวด Mg แล้วปิดจุกทันที (ปฏิกิริยาจะเกิดขึ้นทันทีเมื่อ Mg สัมผัสกับสารละลาย HCl) เขย่าขวดรูปชมพู่จนกระทั่งไม่มีแก๊สเกิดขึ้น สังเกตจาการแก๊สที่ไปแทนที่น้ำในบิวเรต
- จดปริมาตรของน้ำที่หายไป (หน่วย mL)
- ใช้ไม้บรรทัดวัดความสูงของน้ำที่เหลืออยู่ในบิวเรตจากระดับน้ำที่อยู่ในบีกเกอร์ (หน่วยเป็นเซนติเมตร)
- วัดอุณหภูมิของน้ำในบีกเกอร์ (อนุมานว่าเป็นอุณหภูมิของแก๊ส)
การคำนวณ
1. การหาจำนวนโมล
จากปฏิกิริยา จะได้ว่า จำนวนโมลของแก๊สไฮโดรเจน เท่ากับ จำนวนโมลของ Mg
ดังนั้น mol Mg = น้ำหนักลวด Mg / น้ำหนักอะตอม Mg
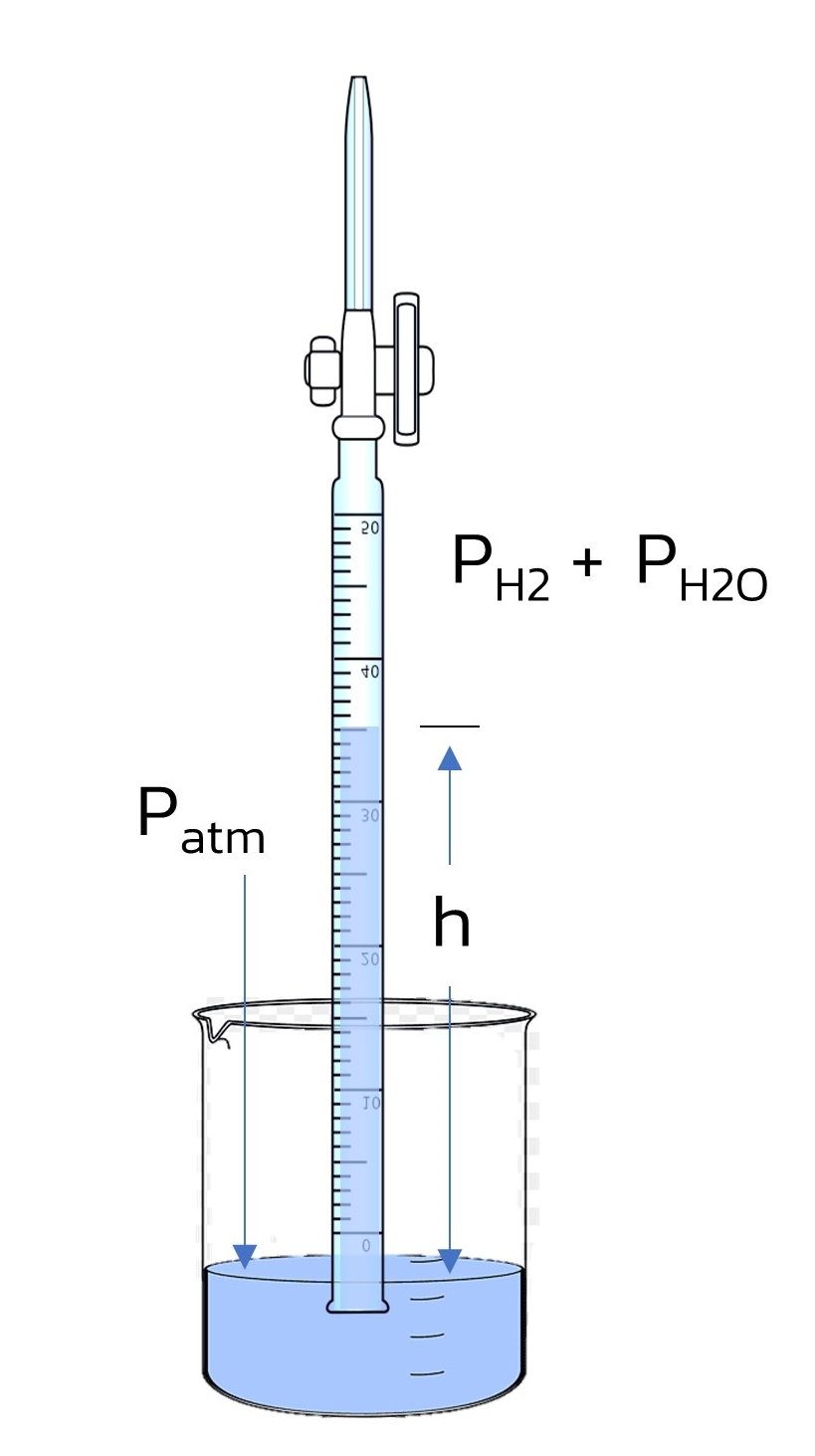
2. การคิดความดันของแก๊ส (ที่ถูกต้อง) ตามภาพที่ 7.2
สมดุลของความดัน
Patm = Pgas + PH2O + Ph
Pgas = Patm – PH2O – Ph (7.4)
เมื่อ Pgas = ความดันของแก๊ส H2
Patm = ความดันบรรยากาศ
PH2O = ความดันอิ่มตัวของน้ำที่อุณหภูมิหนึ่งๆ
Ph = ความดันเนื่องจากน้ำสูง h (cm) ที่เหลือในบิวเรต
ภาพที่ 7.2
ค่า P นี้จะถูกต้องเมื่อระดับน้ำในบิวเรตที่เก็บแก๊สเท่ากับระดับน้ำในบีกเกอร์ แต่ในการทดลองแก๊สแทนที่น้ำได้ไม่หมด ทำให้ระดับน้ำในบิวเรตสูงกว่าระดับน้ำในบีกเกอร์ (ตามภาพที่ 7.2) ดังนั้นจึงต้องใช้สมการ (7.4) เพื่อหาความดันของแก๊สที่ถูกต้อง
ระดับน้ำสูง 1 เซนติเมตร เป็นความดัน 98.088 Pa
ระดับน้ำสูง h เซนติเมตร เป็นความดัน 98.088 x h Pa
กำหนด 760.00 mmHg = 1.01×105 Pa น้ำสูง 1 cm จะมีความดันเท่ากับ 98.088 Pa
3. การหาค่าคงที่ของแก๊ส (R) จากสมการแก๊สอุดมคติ PV = nRT
หาค่า R ได้จากสูตร
R จะอยู่ในหน่วย J/mol K
เมื่อ
n = จำนวนโมลของแก๊สที่เกิดขึ้น
P = ความดันของแก๊สในหน่วย Pa
V = ปริมาตรของแก๊สในหน่วย m3 ซึ่งมีค่าเท่ากับปริมาตรของน้ำที่ถูกแทนที่
T = อุณหภูมิของแก๊ส ในหน่วยเคลวิน (K)
4. การคำนวณร้อยละความเบี่ยงเบน (%R)
% ความเบี่ยงเบน = (R-8.314/8.314) x 100