ผู้ช่วยศาสตราจารย์ ดร.วรวิทย์ จันทร์สุวรรณ
ปรับปรุงล่าสุด: 23 พฤษภาคม 2563
วัตถุประสงค์
- เพื่อฝึกทักษะการหาค่า pH ของสารละลายโดยใช้อินดิเคเตอร์
Download
- บทปฏิบัติการ [pdf]
- รายงานการทดลอง [pdf]
หลักการ
อินดิเคเตอร์คือสารเคมีซึ่งอาจเป็นได้ทั้งสารอินทรีย์หรือสารอนินทรีย์ที่มีสมบัติเปลี่ยนสีได้เพื่อบอกจุดสมมูล (equivalent point) ของสารในกระบวนการไทเทรต อินดิเคเตอร์มีหลายประเภทตามชนิดของปฏิกิริยา แต่ในที่นี้จะศึกษาเฉพาะอินดิเคเตอร์ที่ใช้ในปฏิกิริยากรดเบส (acid-base indicator) ซึ่งเป็นสารอินทรีย์ประเภทสีย้อม (dye) ซึ่งมีสมบัติเป็นกรดหรือเบสอ่อน มี pKa ต่าง ๆ กัน อินดิเคเตอร์แต่ละชนิดมีสีและช่วงการเปลี่ยนสีเฉพาะตัว (ตาม pKIn) ทำให้เลือกใช้อินดิเคเตอร์ที่เหมาะสมสำหรับการบอกจุดยุติ (end point) ตัวอย่างของอินดิเคเตอร์บางชนิดที่นิยมใช้ดังตารางที่ 11.1
ตารางที่ 11.1 ชนิดและการเปลี่ยนแปลงของอินดิเคเตอร์บางชนิดที่นิยมใช้
| อินดิเคเตอร์ | ช่วง pH | pKIn | สีปรากฏในรูปกรด-เบส |
| Thymol blue | 1.2-2.8 | 1.6 | แดง-เหลือง |
| Methyl yellow | 2.9-4.0 | 3.3 | แดง-เหลือง |
| Methyl orange | 3.1-4.4 | 4.2 | แดง-เหลือง |
| Bromocresol green | 3.8-5.4 | 4.7 | เหลือง-น้ำเงิน |
| Methyl red | 4.2-6.2 | 5.0 | แดง-เหลือง |
| Chlorophenol red | 4.8-6.4 | 6.0 | เหลือง-แดง |
| Bromothymol blue | 6.0-7.6 | 7.1 | เหลือง-น้ำเงิน |
| Phenol red | 6.4-7.6 | 7.4 | เหลือง-แดง |
| Cresol purple | 7.4-9.0 | 8.5 | เหลือง-ม่วง |
| Phenolphthalein | 8.0-9.0 | 9.0 | ไม่มีสี-แดง |
| Thymolphthalein | 9.3-10.5 | 9.9 | ไม่มีสี-น้ำเงิน |
| Alizarine yellow | 10.0-12.0 | 11.0 | เหลือง-ม่วง |
การหา pH ของสารละลายโดยการใช้อินดิเคเตอร์
การใช้อินดิเคเตอร์หลายๆ ชนิดในการหา pH ของสารละลายตัวอย่าง ทำโดยการแบ่งสารตัวอย่างออกเป็นส่วนๆ แต่ละส่วนให้เติมอินดิเคเตอร์หนึ่งชนิดลงไป ดังตัวอย่างในตารางที่ 11.2
ตารางที่ 11.2 สีของสารละลายที่ปรากฏเมื่ออินดิเคเตอร์ชนิดต่างๆ
| อินดิเคเตอร์ | ช่วง pH | ช่วงการเปลี่ยนสี | สีของสารละลาย |
| Phenol red | 6.4-7.6 | เหลือง-แดง | เหลือง |
| Methyl red | 4.2-6.2 | แดง-เหลือง | ส้ม |
| Bromothymol blue | 6.0-7.6 | เหลือง-น้ำเงิน | เขียว |
| Cresol purple | 7.4-9.0 | เหลือง-ม่วง | เหลือง |
จากข้อมูลในตารางที่ 11.2 สามารถนำมาพิจารณาหาช่วง pH ของสารละลายตัวอย่างได้โดยเขียนช่วง pH ที่แสดงของอินดิเคเตอร์ ดังแผนภาพต่อไปนี้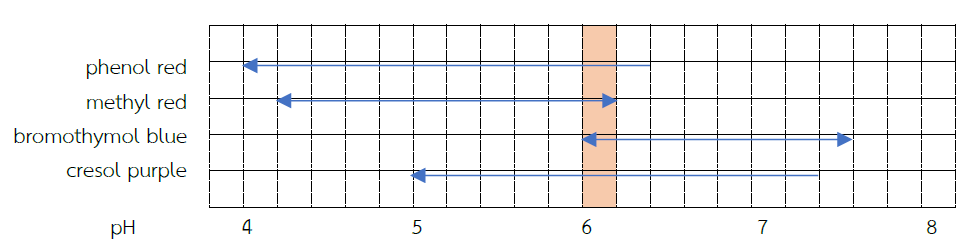
ภาพที่ 11 .1 ช่วง pH ของสารละลายตัวอย่าง
ช่วง pH นี้สีที่ปรากฏเป็นจริงสำหรับทุกอินดิเคเตอร์ จะเห็นว่ามีช่วง pH ที่ซ้อนทับกันของทุกอินดิเคเตอร์ สรุปได้ว่าช่วง pH ของสารละลายตัวอย่างมีค่าระหว่าง 6.0-6.2
อุปกรณ์และสารเคมี
อุปกรณ์
- หลอดทดลอง
- หลอดหยด
- กระดาษวัด pH
- กระดาษลิตมัส
สารเคมี
- อินดิเคเตอร์ (ห้องปฏิบัติการเตรียม)
วิธีการทดลอง
ตอนที่ 1 การหา pH ของสารละลายตัวอย่างโดยการใช้อินดิเคเตอร์
- รับสารละลายตัวอย่าง จดหมายเลขและรายละเอียด ทดสอบด้วยกระดาษลิตมัส
- แบ่งใส่หลอดทดลอง 4 หลอด ๆ ละประมาณ 2 mL (40 หยด) หยดอินดิเคเตอร์ 3 หยด ลงไปดังนี้
| สารละลายเป็นกรด | สารละลายเป็นเบส |
| หลอดที่ 1 หยด thymol blue | หลอดที่ 1 หยด bromothymol blue |
| หลอดที่ 2 หยด methyl orange | หลอดที่ 2 หยด cresol purple |
| หลอดที่ 3 หยด methyl red | หลอดที่ 3 หยด phenolphthalein |
| หลอดที่ 4 หยด bromothymol blue | หลอดที่ 4 หยด alizarine yellow |
- เขย่าหลอดทดลองเบา ๆ บันทึกสีที่ปรากฏในแต่ละหลอด
- เปรียบเทียบโดยนำตัวอย่าง วัดค่า pH โดยใช้กระดาษวัด pH
